Die angeborenen Systeme der Zellerkennung basieren auf Oberflächenproteinen oder intrazellulären Proteinen in Epithelzellen, Neutrophilen, Makrophagen und dendritischen Zellen sowie auf löslichen zytoplasmatischen Rezeptoren. Alle diese Rezeptoren werden generell als PRRs (Pattern Recognition Receptors/Mustererkennende Rezeptoren) bezeichnet; diese erkennen die PAMPs (Pathogen-Associated Molecular Patterns/Pathogen-assoziierte molekulare Muster), die nur von einem Pathogen exprimiert werden (Lipopolysaccharide, bakterielle Kohlenhydrate und Lipoproteine, Peptidoglykane, RNA, DNA, etc.) bzw. auch von der kommensalen Flora.

Angeborene Systeme der Pathogenerkennung
TLR (Toll-like-Rezeptoren). Beim Schwein wurden bislang zehn verschiedene Mitglieder dieser Toll-Proteinfamilie identifiziert. Sie sind in der Lage, bakterielle Produkte außerhalb der Zellen und virale Nukleinsäure innerhalb der Zelle zu erkennen. Manche TLRs sind daher in intrazellulären Kompartimenten lokalisiert, um virale oder bakterielle Nukleinsäure zu erkennen. Andere TLRs befinden sich auf der Zelloberfläche und erkennen bakterielle Produkte (Lipoproteine, Peptidoglykane, Lipopolysaccharide).
RLR (RIG-I [Retinoic acid-inducible gene/Retinsäure-induzierbares Gen]-like-Rezeptoren) sind zytoplasmatische Rezeptoren, die die virale dsRNA erkennen.
NOD (Nucleotide-binding oligomerization domain/Nucleotid-bindende Oligomerisationsdomäne)-Proteine sind zytosolische PRRs, die bei der Erkennung bakterieller Produkte mit den TLRs kooperieren.
CLR (C-type lectin receptors/C-Typ-Lektin-Rezeptoren) sind eine Familie von Oberflächenrezeptoren, zu der unter anderem Kollektine, Pentraxine, Selektine, Dektine und Mannoserezeptor zählen.
Proteine, die zum Komplementsystem und zu den Akute-Phase-Proteinen gehören, sind in der Lage, als lösliche Erkennungsrezeptoren zu agieren: C3-Fragmente, Mannose-bindendes Protein (MBP), Surfactant, C-reaktives Protein (CRP).
Die gegenseitige Aktivierung der Zellen auf unterschiedlichem Gewebeniveau, also von Epithel- und Endothelzellen und insbesondere Entzündungszellen und Zellen der angeborenen Immunabwehr, stellt durch das Auslösen der Entzündungsantwort die erste physikalische und funktionelle Barriere gegen Pathogene dar.
Tabelle 1: Angeborene Systeme der Pathogenerkennung.
| REZEPTOREN | AKTIVITÄT | ||
| TLR-Familie (membranständig oder intrazellulär) | Erkennung von bakteriellen und Pilz-Produkten | TLR1 | Lipopeptide (Bakterien und Mykoplasmen) |
| TLR2 | Lipoproteine und Proteoglykane (gram+) Lipopeptide (Mykoplasmen) LPS (Leptospira) Lipoarabinomannan (Mycobacterium) Lipopeptide (Mykoplasmen) (gram+) Zymosan (Pilze) |
||
| TLR4 | LPS (gram-) F-Protein des Respiratory Syncytial Virus (RSV) HSP60 (Chlamydia) |
||
| TLR5 | Flagellin (viele Bakterien) | ||
| TLR6 | Reguliert TLR2 Lipopeptide (Mykoplasmen) Lipopeptide (Mykoplasmen) (gram-) Zymosan (Pilze) |
||
| TLR9 | CpG-Regionen bakterieller DNA | ||
| TLR10 | Unbekannt | ||
| Erkennung viraler Produkte | TLR3 | dsRNA | |
| TLR7 TLR8 |
ssRNA. Beschränkt auf pDCs, nicht exprimiert auf cDCs | ||
| TLR9 | CpG-Regionen viraler DNA. Beschränkt auf pDCs, nicht exprimiert auf cDCs | ||
|
CLR-Familie |
Selektine, Dektin-1,-2, |
Erkennt die Kohlenhydratdomäne auf Pathogenen und induziert die Phagozytose oder die Aktivierung des Inflammosoms, mit Produktion proinflammatorischer Zytokine; zielt insbesondere auf die Immunantwort in Richtung TH1- oder TH17-Finalisierung ab. | |
|
RLRs |
RIG-1  |
Bindet ssRNA während der Replikation der viralen RNA, induziert die Produktion von proinflammatorischen Zytokinen und Typ-I-IFNs und bringt infizierte Zellen in einen antiviralen Zustand. | |
| NOD-Proteine (zytoplasmatisch-intrazellulär) | NOD1 NOD2 |
Interaktion mit mikrobiellen Komponenten (Proteoglykan-Anteile) über ihre spezifische Region. Porzine NODs werden in hohem Maße in den Mesenteriallymphknoten und im Darm-assoziierten Lymphgewebe (GALT) exprimiert und behalten so ihre Rolle in der angeborenen Immunantwort gegen bakterielle Infektionen. | |
|
APPs (Akute- Phase-Proteine) |
C-reaktives Protein (CRP) | Wird in der Leber produziert, bindet Phosphatidylcholin-Reste auf der Zellwand mancher Bakterien und Pilze, aktiviert das Komplement-System über den klassischen Weg und steigert die Phagozytose durch Makrophagen (Opsonin-vermittelte Phagozytose). | |
| Mannose-bindendes Lektin (MBL) | Ein Kollektin mit Lektindomänen, das in der Lage ist, Mannose-enthaltende Zucker zu binden und so eine Vielzahl an Viren, Bakterien, Pilzen und Protozoen zu erkennen. MBL kann das Komplement-System auf klassischem Weg oder C1-abhängig aktivieren, was die Opsonin-vermittelte Phagozytose fördert. |
Spezifische Systeme der Pathogenerkennung
Spezifische B- und T-Zellen verfügen über Rezeptoren, die spezifische Antigendeterminanten (Epitope) des Pathogens erkennen.
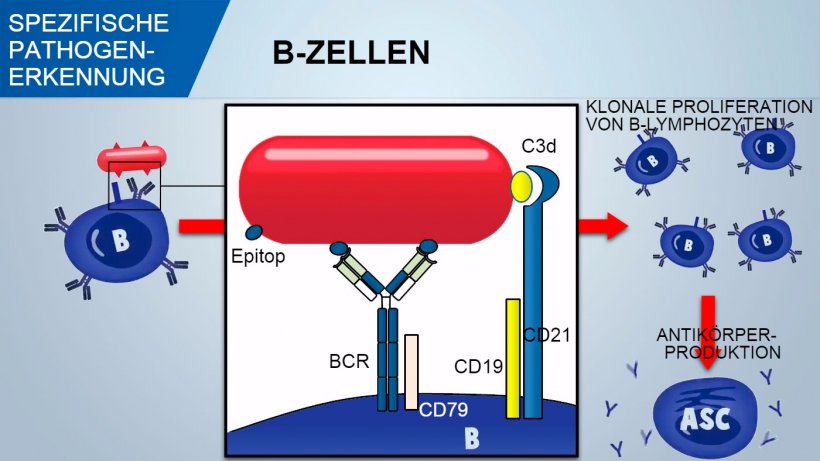
Naive B-Lymphozyten besitzen multiple Oberflächenrezeptoren, genannt B-Zell-Rezeptoren (BCR), die aus einem für nur ein Antigen spezifischen Oberflächenimmunglobulin (IgM oder IgD) bestehen. Während der Entwicklung der B-Zellen im Knochenmark wird durch genetische Rekombination ein enormes Repertoire an BCRs und folglich an B-Zellen geschaffen, die später eine riesige Anzahl spezifischer Antigene auf den Pathogenen erkennen können.
T-Zell-Rezeptoren (TCR) der T-Helferzellen und der zytotoxischen T-Lymphozyten bestehen aus zwei α- und β-Ketten. TCR der γ-δ-T-Zellen setzen sich aus zwei gamma- und delta-Ketten zusammen. Nach einem ähnlichen Mechanismus kommt es zur Variabilität der Antigenerkennung von TCR auf T-Lymphozyten.
B-Zellen erkennen native Antigendeterminanten des Pathogens und das Signal wird innerhalb der Zelle durch Aktivierung eines assoziierten Glykoproteins (CD79α/β) übermittelt. Sobald der BCR-Antigen-Komplex internalisiert wurde, verarbeiten die B-Zellen das Antigen und präsentieren es in Verbindung mit MHC II den T-Helferzellen. Die Co-Stimulation zwischen B- und T-Zellen ist essenziell für die Aktivierung der B-Zellen und für das Einleiten einer effizienten Antikörperbildung. Eine wirksame Co-Stimulation erfordert auch ein durch den CD21/CD19-Komplex vermitteltes Signal, da dieser Komplex die Komplementfragmente (C3d) auf dem Pathogen erkennt.
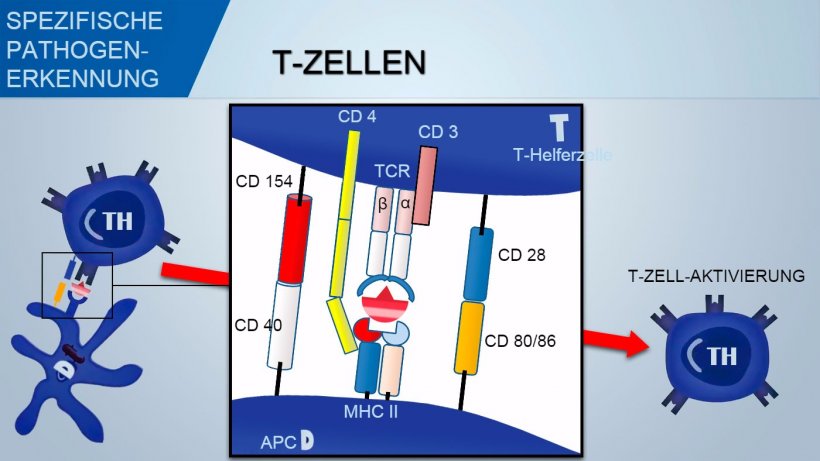
Im Gegensatz dazu erkennen T-Zellen jene Antigendeterminanten, die verarbeitet und von den APCs in Assoziation mit dem MHC (Major Histocompatibility Complex) präsentiert wurden.
MHC-Klasse-II-Komplexe sind Moleküle, die meist auf der Oberfläche von spezifischen antigenpräsentierenden Zellen (APC) wie reifen dendritischen Zellen, aktivierten inflammatorischen Makrophagen und aktivierten B-Zellen vorhanden sind. MHC-Klasse-I-Komplexe präsentieren endogene Antigene den zytotoxischen T-Lymphozyten.
Beim Schwein werden MHC als SLA (Swine Leukocyte Antigen/Schweine-Leukozyten-Antigen-Komplex) bezeichnet, der sich aus 70, auf drei Klassen verteilten Genen zusammensetzt.
Die Gene des SLA befinden sich beim Schwein im Centromer von Chromosom 7. Die erstmals 1970 beschriebenen 70 Gene (Haplotypen) werden in drei Klassen eingeteilt:
- SLA-I kodieren für MHC-I-Moleküle, die von den meisten kernhaltigen Zellen - außer Neuronen und Trophoblasten - exprimiert werden. MHC-Moleküle präsentieren den CD8+-Zellen die Antigene intrazytoplasmatisch (z.B. virale Antigene). MHC-I-Moleküle bestehen aus einer schweren α-Kette (hoch polymorph) und zwei leichten β-Ketten, die als β2-Mikroglobulin bezeichnet werden.
- SLA-II: MHC-Klasse-II-Moleküle werden von B-Lymphozyten, nicht spezifischen APCs und manchen Subpopulationen von T-Lymphozyten ungeachtet deren Aktivierungsstatus exprimiert. MHC-Klasse-II-Moleküle sind assoziiert mit verarbeiteten Antigenen (phagozytierte und in Peptide aufgespaltene Antigene) innnerhalb der APCs. MHC-Klase-II-Moleküle bestehen aus einer α-Kette und einer β-Kette.
- SLA-III sind Gene, die für Komplementelemente, Zytokine, etc. kodieren.
Zur Aktivierung der T-Helferzellen sollte das durch TCR-Erkennung des Antigen-MHC-Komplexes vermittelte Signal mit einem Signal assoziiert sein, das über die Bindung von co-stimulatorischen Oberflächenmolekülen vermittelt wird: CD28 (auf T-Zellen) bindet an CD80 (auf APCs) oder CD86 (auf B-Zellen), während CD40 (auf APCs) an CD154 (auf T-Zellen) bindet. Diese Co-Stimulation fördert die Produktion von Zytokinen für die T-Zell-Proliferation (IL-2) und auch die Zytokin-getriebene TH-Differenzierung.






