Einführung
Der Enzymimmunoassay (ELISA) zum Nachweis von Proteinen (Antigenen oder Antikörpern) ist eines der weltweit am leichtesten verfügbaren Diagnoseinstrumente und wird heutzutage in der Schweinezucht intensiv genutzt. Der Test wird für gewöhnlich zur Überwachung und Krankheitsbeobachtung sowie als Diagnoseinstrument eingesetzt. Da Schweinetierärzte dieses Instrument häufig verwenden, ist es wichtig zu verstehen, wie der Test funktioniert, was er nachweist und welche Vor- und Nachteile er bei der Interpretation der Ergebnisse hat. Ebenso ist zu berücksichtigen, dass, obwohl dieselbe Technologie für verschiedene Krankheitserreger verwendet wird, die Ergebnisse unterschiedlich interpretiert werden müssen.
Informationen zum Test
ELISA-Tests dienen dem Nachweis von Antigenen oder Antikörpern gegen Bakterien oder Viren. Antigene sind Fremdproteine, die die Antikörperproduktion anregen (Antigen = Antikörpergenerator). Denken Sie daran, dass Antikörper immer gegen Proteine gerichtet sind. Bei der Entwicklung des Tests entscheidet der Hersteller oder das Labor, welches spezifische Protein oder welche Proteine anvisiert werden sollen. Wenn der ELISA-Test direkt auf das Protein des Bakteriums oder Virus ausgerichtet ist, wird er als Antigen-ELISA bezeichnet, während er, wenn das Ziel die Antikörperreaktion des Tieres auf das Bakterium oder Virus ist, Antikörper-ELISA genannt wird. Obwohl es ELISA-Tests gibt, die nur auf ein oder zwei Proteine (Antikörper oder Antigene) abzielen, sind die meisten auf eine große Anzahl von Proteinen ausgerichtet. Die Tests können auch so konzipiert sein, dass sie eine bestimmte Art von Antikörperreaktion (IgG, IgM oder IgA) oder eine Kombination davon nachweisen. Jede dieser Arten von Antikörpern hat spezifische Funktionen, deren Beschreibung den Rahmen dieses Artikels jedoch sprengen würde.

Der Nachweis von Antikörpern und Antigenen mittels ELISA beruht auf dem gleichen Konzept und Verfahren. Als Erstes wird das Zielprotein (Antigen oder Antikörper) gewonnen. Für einzelne Proteine ist ein separates Verfahren zur Gewinnung einer gereinigten Konzentration dieses einzelnen Proteins erforderlich. Die Bestimmung des oder der Zielproteine ist ein komplexer wissenschaftlicher Prozess. Im Idealfall zielt der Test auf ein einzelnes Protein ab, das für den betreffenden Erreger einzigartig ist (keine Kreuzreaktion mit anderen Erregern), eine hohe Immunogenität aufweist (für den Antikörpernachweis) oder in hohen Konzentrationen vorkommt (für den Antigennachweis); er zielt auf ein Protein ab, von dem bekannt ist, dass es in hohem Maße mit dem Schutz vor Krankheiten korreliert und immer vorhanden ist. Leider sind viele dieser Kriterien nicht bekannt, sodass stattdessen oft ein einzelnes Protein, das leicht hergestellt und in der Probe gefunden werden kann, oder ein Gemisch aus mehreren Proteinen (z. B. ein ganzes Virus oder Bakterien) verwendet wird. Doch wenngleich die Verwendung ganzer Viren oder Bakterien als Zielproteine einfacher ist, ist die Wahrscheinlichkeit einer Kreuzreaktion mit anderen Krankheitserregern höher.
Hier sind die allgemeinen Schritte des Prozesses (s. Abb. 1).
- Schritt 1: Eine Mikrotiterplatte wird mit dem/den Zielantigen(en) (zum Nachweis von Antikörpern) oder Antikörper(n) (zum Nachweis von Antigenen) vorbeschichtet.
- Schritt 2: Die Probe wird in den Test geben und inkubiert, damit sich Antigen und Antikörper binden können.
- Schritt 3: Die Probe wird entfernt und es werden spezielle Antikörper hinzugegeben, die an der gegenüberliegenden Seite der Antikörper (unterer Teil des Antikörper-"Y" beim Antikörpernachweis) oder Antigene (oberer Teil des "Y" beim Antigennachweis) anhaften. Die Probe wird inkubiert, um die Bindung zu ermöglichen, und dann abgewaschen, um sicherzustellen, dass alle ungebundenen (d. h. nicht anvisierten) Antikörper bzw. Antigene entfernt werden.
- Schritt 4: Ein mit einem Fluoreszenzstoff markierter Nachweisantikörper wird hinzugegeben. Dieser lagert sich an die in Schritt 3 hinzugefügten speziellen Antikörper an (am unteren Teil des Antikörper-"Y"; dasselbe Ziel beim Antigen- und beim Antikörpernachweis). Die Probe wird erneut inkubiert, um die Bindung zu ermöglichen, und dann abgewaschen, um sicherzustellen, dass alle ungebundenen markierten Antikörper entfernt werden.
- Schritt 5: Ein Reagenz, das die Fluoreszenz der verbleibenden markierten Antikörper auslöst, wird hinzugegeben und inkubiert, um die Bindung sicherzustellen.
- Schritt 6: Die Probe wird in der Regel mit einem speziellen Gerät abgelesen, das auf eine bestimmte Wellenlänge geeicht ist, um die Farbveränderung zu quantifizieren (als Absorption bezeichnet). Das Verfahren kann geringfügig variieren, je nachdem, ob es sich um einen direkten, indirekten oder Sandwich-ELISA handelt, wobei jeder dieser Tests unterschiedliche Vor- und Nachteile hat (die hier nicht erörtert werden), aber letztendlich liefern sie alle die gleichen Ergebnisse: je höher die Absorption bzw. Farbänderung, desto höher die erwartete Konzentration des Zielantigens oder -antikörpers in der untersuchten Probe.
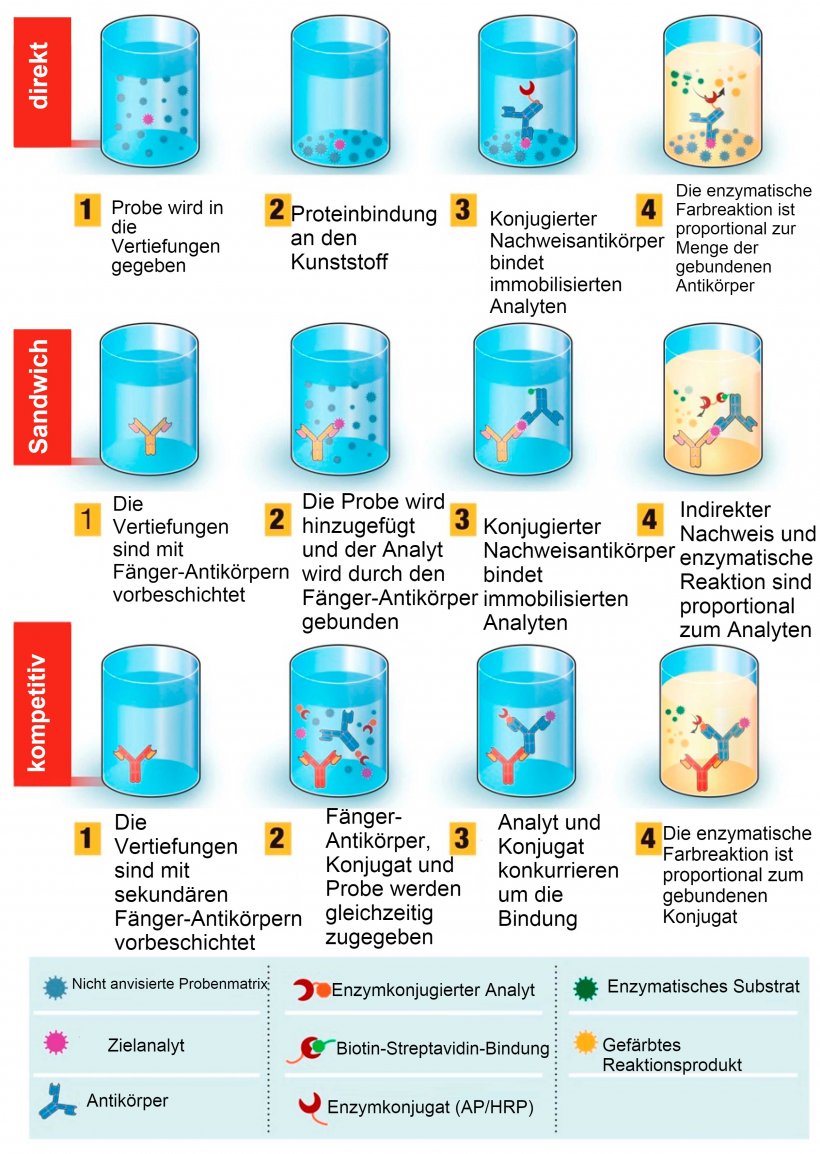
Abb. 1: Überblick über diagnostische Tests auf der Grundlage von ELISA (enzyme-linked immunosorbent assay). ELISA-Tests können in verschiedenen Formaten angeboten werden, die sich in der Antigen-Immobilisierung und Antikörper-Markierung unterscheiden. Beim direkten ELISA werden Virusantigene, die an eine Kunststoff-Festphase gebunden sind, durch Zugabe eines konjugierten Antikörpers nachgewiesen. Beim Sandwich-ELISA wird der Fänger-Antikörper auf die Kunststoff-Festphase fixiert. Das Antigen in der Probe bindet sich an den Fänger-Antikörper und wird dann von einem zweiten enzymmarkierten Antikörper nachgewiesen. Beim kompetitiven ELISA wird das Virusantigen der Probe mit dem primären Antikörper vorinkubiert und dann zusammen mit einem enzymkonjugierten Antigen, das mit dem Probenantigen um die Bindung an den primären Antikörper konkurriert, in eine mit einem sekundären Antikörper beschichtete Vertiefung gegeben. Je mehr Virusantigen in der Probe vorhanden ist, desto weniger konjugiertes Antigen wird gebunden und desto geringer ist das Signal. Quelle: angepasst von Ghaffari et al. 2020.
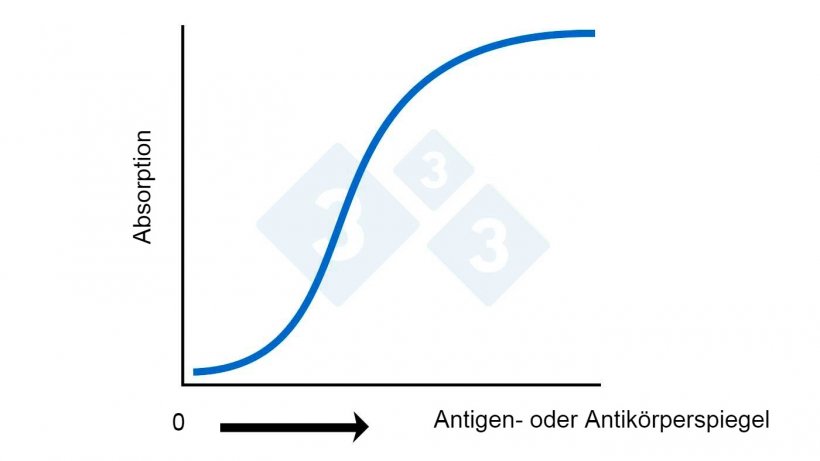
Abb. 2A: ELISA – Berechnung des Antigen- oder Antikörperspiegels anhand der Absorption
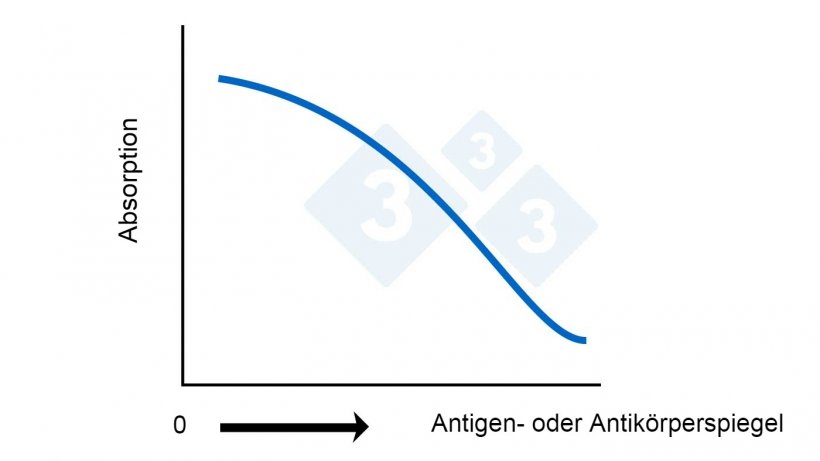
Abb. 2B: Kompetitiver ELISA. Berechnung des Antigen- oder Antikörperspiegels anhand der Absorption.
Der Cutoff-Wert kann für jeden ELISA-Test unterschiedlich sein und wird vom Hersteller je nach der von ihm angestrebten Sensitivität und Spezifität im Voraus festgelegt. Bei direkten, indirekten und Sandwich-ELISA-Tests gilt jede Zahl, die über dem Cutoff-Wert liegt, als positives Ergebnis. Bei kompetitiven ELISA-Tests gilt jede Zahl, die über dem Cutoff-Wert liegt, als negatives Ergebnis. Bei einigen Tests wird auch eine Grauzone definiert, in die Proben als „verdächtig“ eingestuft werden, da der Test dazu neigt, einige Hintergrund-Reaktionen (Kreuzreaktionen) anzuzeigen, die eine klare Abgrenzung erschweren.
Die Ergebnisse werden in der Regel, aber nicht immer, als korrigiertes S/P-Verhältnis angegeben, d. h. als Verhältnis von Probe zu Positivkontrolle, das um die in den Vertiefungen der Negativkontrollen festgestellte Hintergrundfarbänderung korrigiert wird. Die Antikörperspiegel werden häufig als „Titer“ bezeichnet. Obwohl dies technisch nicht korrekt ist, lässt es sich aus einer allgemeinen Perspektive heraus rechtfertigen. Ein wichtiger Punkt ist, dass es bei Titern eine direkte mathematische Beziehung zwischen den Werten gibt (ein Wert von 20 hat doppelt so viele Antikörper wie eine Probe mit einem Wert von 10). Bei ELISA-Werten besteht diese direkte mathematische Beziehung nicht (s. Abb. 2A), denn bei einem ELISA-Wert von 2,0 sind deutlich mehr als doppelt so viele Antikörper vorhanden als bei einem Wert von 1,0.
Pooling von Proben für die Testung
Da ELISA-Tests konzentrationsabhängig sind (sie korrelieren direkt mit der Konzentration des Zielproteins [Antikörper oder Antigen]), wird vom Pooling von Proben für die Testung dringend abgeraten. Das Pooling kann die Wahrscheinlichkeit, eine positive Probe zu übersehen, erheblich erhöhen.
Einige Verwendungszwecke für ELISA-Tests:
- Nachweis von Antikörpern gegen einen bestimmten Erreger – Antikörper-ELISA – häufigste Verwendung
- Bestimmung der Exposition gegenüber Krankheitserregern
- Bestimmung des Impfstatus eines Tieres
- Bestimmung des Zeitpunkts der Infektion (Veränderung des Antikörperspiegels) im Laufe der Zeit
- Nachweis des Zielerregers über den Nachweis von Protein/Antigen des Zielerregers – Antigen-ELISA




