Das Virus des Porzinen Reproduktiven und Respiratorischen Syndroms (PRRS) zeichnet sich je nach Virusisolat durch eine hohe genetische und antigene Variabilität aus, was zu unterschiedlichen wirtschaftlichen Auswirkungen führt, je nachdem, welche Krankheit es im Betrieb hervorruft. Laut einer Studie von Nathues et al. (2017) können die Kosten eines PRRS-Ausbruchs in einem Zucht- und Mastbetrieb zwischen 101 € und 650 € pro Sau und Jahr liegen.
Pathogene Auswirkungen von atypischem PRRS

Seit Jahren werden hochvirulente Ausbrüche auf PRRS-Viren mit atypischer Pathogenität zurückgeführt. Im Allgemeinen ist der Genotyp 1 der häufigste Genotyp in europäischen Ländern. Genotyp 1 wird mit weniger virulenten Ausbrüchen in Verbindung gebracht, hauptsächlich weil er weniger systemische und respiratorische Symptome erzeugt als Genotyp 2, der in Amerika und Asien der vorherrschende Genotyp ist. Im Jahr 2001 entdeckte man im Bundesstaat Minnesota einen hochvirulenten Stamm, der als MN184 bezeichnet wurde. Dieser Stamm wurde laut einer Studie von Shi et al. (2010) später mit kanadischen Stämmen in Verbindung gebracht. Im Jahr 2006 entdeckte man einen hochvirulenten in China, der sich innerhalb weniger Monate in Dutzenden von Provinzen ausbreitete. Die von ihm verursachten Ausbrüche in landwirtschaftlichen Betrieben führten in einigen Fällen zu Abortraten über 40 %. Auf dem europäischen Kontinent wurde 2007 in einem Betrieb in Belarus der Lena-Stamm (Genotyp 1 und Subtyp 3) isoliert, der Reproduktionsprobleme und eine hohe Sterblichkeit von teilweise über 70 % bei Masttieren aufwies. In einem Aufzuchtbetrieb in Italien wurde 2014 ein Stamm namens PR40 entdeckt, der als hochpathogen klassifiziert wurde und von einer hohen Sterblichkeit (bis zu 50 %) gekennzeichnet war.
Der Ursprung dieser Stämme
Die Mechanismen, bei denen diese PRRS-Virusstämme entstehen, sind nicht genau bekannt. Es gibt mehrere Hypothesen. Eine der möglichen Ursachen für das Auftreten dieser Viren wären die genetischen Variationen, die im ursprünglichen viralen Genom auftreten. In wissenschaftlichen Studien wie derjenigen zum chinesischen Stamm von 2006 wurden Deletionen in der Nsp2-Region nachgewiesen, die sogar als Marker zur Unterscheidung dieses hochpathogenen Stammes verwendet wurden. Im Lena-Stamm wies man ein kleineres N-Protein und ein größeres GP4-Protein nach.
Wirkungsweise von hochvirulenten Stämmen
Im Hinblick auf die pathogene Wirkung dieser Stämme stellten Cho et al. (2007) fest, dass bei der Inokulation mit einem hochvirulenten PRRS-Virus des Genotyps 2 (MN-184) die Viruslasten in den infizierten Schweinen in Tonsillen und Seren deutlich höher waren als bei einem Stamm mit niedriger Virulenz. In anderen Studien von Frydas et al. (2013, 2015, 2018) ließen sich in Aerosolen über einen längeren Zeitraum vorhandene Viren nachweisen.
Merkmale von hochvirulenten Stämmen im Vergleich zu den anderen Stämmen:
- Verursachen schneller mehr Schaden
- Befallen die Lunge und anderes Gewebe des Lymphsystems wie Thymus oder Knochenmark
- Führen zu länger anhaltendem Fieber (>41°C), einer geringeren durchschnittlichen Gewichtszunahme pro Tag, einer höheren Sterblichkeit und höherer Virämie
-
Führen zu erhöhter Atrophie des Thymus
In einigen Studien mit hochvirulenten Stämmen wurden hohe IL-10-Spiegel in den frühen Phasen der Infektion festgestellt, die das Überleben des Virus erhöhen und den Beginn der schützenden Immunität verzögern könnten. Außerdem sah man niedrige IL-4-Spiegel, die die Immunantwort der Tiere behindern. Carnelli et al. (2017) verglichen einen hochvirulenten italienischen Stamm (PR-40) mit einem anderen Stamm, der als niedrigvirulent gilt, und beobachteten, dass auch die neutralisierende Antikörperantwort geringer war. Gimeno et al. (2011) stellten eine Verbindung zwischen der TNF-α-Induktion von PRRSV-Stämmen und ihrem Virulenzgrad her.
Hochvirulente PRRS-Virusstämme verursachen bei Schweinen ausgeprägtere klinische Symptome, eine höhere Sterblichkeit, eine höhere Viruslast und Verbreitung im Körpergewebe, eine stärkere Entzündungsreaktion und in einigen Fällen ist die vom Tier entwickelte Immunreaktion weniger effektiv.
Epidemiologische Implikationen
Auf Ebene der regionalen PRRS-Kontrolle kann das Vorkommen einiger hochpathogener Stämme, die zu höheren Viruslasten und einer größeren Ausscheidung führen, die Eindämmung des Virus behindern und das Risiko der Ausbreitung auf andere Betriebe erhöhen. Die Intensivierung aller externen Biosicherheitsmaßnahmen und die Sicherstellung des optimalen Immunstatus der in den Betrieben einer Region gehaltenen Schweine sind nützliche Instrumente, um die schnelle Ausbreitung zu verhindern und die damit verbundenen schweren wirtschaftlichen Verluste zu vermeiden.
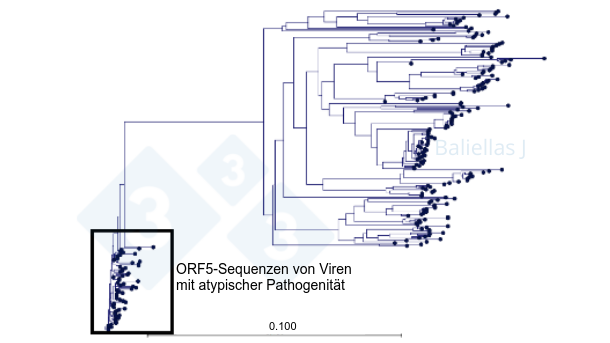
Die zunehmende „Globalisierung“ der Tiertransporte aufgrund des Imports von Ferkeln, Ersatzsauen und Schlachtschweinen erhöht die Wahrscheinlichkeit, dass Stämme in eine Region eindringen, die sich von den dort typischen Stämmen unterscheiden, was eine größere Herausforderung für das Immunsystem bedeuten kann. Der Austausch von Informationen über Ausbrüche und Sequenzen in einer Region erlaubt es, das mögliche Vorkommen hochvirulenter Stämme festzustellen und zu versuchen, deren Ausbreitung zu reduzieren. Abbildung 1 zeigt zum Beispiel einen phylogenetischen Baum mit der Historie der ORF5-Sequenzen, die in einer Region über einen Zeitraum von 4 Jahren entdeckt wurden, und die Position, welche die Sequenzen eines Stammes mit atypischer Pathogenität, der sich in derselben Region in kurzer Zeit weit verbreitete, im phylogenetischen Baum einnehmen. Auf diese Weise kann uns die ORF5-Sequenz des Stammes, der in einem Betrieb mit einem klinischen Ausbruch vorkommt, dabei helfen vorherzusagen, ob es sich um ein PRRS-Virus mit atypischer Pathogenität handelt.
Die Komplexität der Bekämpfung von PRRSV nimmt zu, wenn wir Situationen vorfinden, in denen die Auswirkungen durch einen hochvirulenten Stamm verursacht werden. Die Verbesserung und Aufrechterhaltung eines hohen Niveaus an Biosicherheit und ein optimaler Immunstatus sind Maßnahmen, die uns helfen, die Auswirkungen dieser Art von Stämmen abzuschwächen.