Enterotoxische Escherichia coli (ETEC) bleibt die wichtigste Krankheits- und Todesursache bei neugeborenen und gerade abgesetzten Ferkeln. Schweine, die nach dem Absetzen Diarrhö (Diarrhö bei Absetzferkeln; PWD) entwickeln, tun dies im Allgemeinen innerhalb von 3-10 Tagen. ETEC-Stämme, die PWD hervorrufen, besitzen zwei Arten von Virulenzfaktoren: Adhäsine und Enterotoxine, die beide für die klinische Ausbildung von PWD maßgeblich sind. Porzine ETEC-Isolate produzieren eines von fünf verschiedenen Adhäsinen, die alle Fimbrien (oder Pili) sind: K88 (F4), K99 (F5), 987P (F6), F41 (F7) und F18. Die fimbrialen Adhäsine K88 und F18 treten in verschiedenen antigenischen Formen auf, wobei zur häufig vorkommenden fimbrialen Variante K88 auch K88ab, K88ac und K88ad gehören. Fimbriale Adhäsine binden an spezifische Rezeptoren auf dem Bürstensaum der Enterozyten des Dünndarms, was die Bakterien in die Lage versetzt, die Zelloberfläche zu besiedeln und Toxine abzusondern. Die wichtigsten Toxine, die von ETEC-Stämmen gebildet werden und zu PWD führen, sind das hitzelabile Enterotoxin (LT), das hitzestabile Enterotoxin Typ A (STa), das hitzestabile Enterotoxin Typ B (STb) und (oder) das hitzestabile Enterotoxin der enteroaggregativen E. coli (EAST1). Enterotoxin Stx2e (Shiga-Toxin), ebenso bekannt als Faktor der Ödemkrankheit, ist die Ursache von Läsionen, die mit der Ödemkrankheit bei Schweinen verbunden sind (s. Übersicht der Tabelle 1).
Interessanterweise besitzt die B-Untereinheit von LT (LTB) immunmodulatorische Eigenschaften, was zur Apoptose (Zelltod) von CD8-positiven T-Zellen, der Aktivierung von B-Zellen und einer Alteration der Zytokinsekretion durch die Monozyten führen kann. Die adjuvanten Eigenschaften von LTB wurden in einer Studie belegt, in der ein besserer Schutz vor ETEC-PWD bei abgesetzten Ferkeln durch einen E. coli -Lebendimpfstoff festgestellt wurde, der die Gene für LTB und K88ac besaß, im Vergleich zu einem isogenen Stamm, dem das Gen für LTB fehlte. Der Stamm, der nur LTB besaß, war nicht fähig, eine schützende Immunität zu erzeugen. Demgegenüber sind die Toxine STa und STb kleine Moleküle, die als wenig immunogen gelten. Diese Antigene allein können beim Schwein keine anti-STa- und anti-STb-Immunantworten hervorrufen, die für einen effektiven Schutz vor PWD erforderlich sind.

Tabelle 1: Übersicht der Virulenzfaktoren von ETEC, die mit PWD assoziiert sind (aus: Zhang, 2014).
| I. Adhäsine | Literaturhinweise | |
| Fimbriale Adhäsine | Morphologie (Durchmesser) & strukturelle Untereinheit (kDa) | |
| K88 (F4) | Fibrillär (2,1 nm), FaeGa(27,6)/FaeCb(16,9) | Bakker et al., 1991 |
| K99 (F5) |
Fibrillär (4,8 nm), FanCa(16,5)/FanFb(31,5) |
Isaacson, 1977; Bakker et al., 1991 |
| 987P (F6) | Fimbrial (7.0 nm), FasAa(23.0)/FasFb(17.5)/FasGb(40) | Isaacson & Ritcher, 1981; Edwards et al., 1996 |
| F41 (F7) | Fibrillär (3.2 nm), Fim41aa(29.5) | deGraaf, 1982 |
| F18 (F107; 2134P; CFA8813) | Fibrillär (3-4 nm), FedAa(15.1)/FedFb(30.3) | Imberechts et al., 1996; Nagy et al., 1997 #17795; Smeds et al., 2001 |
| Nicht-fimbriale Adhäsine | ||
| AIDA-I | Autotransporter-Protein, AidA (79.5c) | Benz & Schmidt, 1992; Benz & Schmidt, 2001 |
| ppa | Außenmembranprotein, Paa (27.6) | Batisson et al., 2003 |
| EAE | Außenmembranprotein, EaeA (94-97) | Jerse & Krapper, 1991 |
| II. Toxine | Gen, reifes Toxinprotein | |
| LT | eltAB, 1:5 AB holotoxin (86 kDa) | Sixma et al., 1991; Streatfield, 1992 |
| STa | estA, 18-Aminosäuren-Peptid (2kDa) | Dreyfus et al., 1983 |
| STb | estB, 48-Aminosäuren-Peptid (5.1 kDa) | Lee et al., 1983; Dreyfus et al., 1992 |
| EAST1 | astA, 38-Aminosäuren-Peptid (4.1 kDa) | Nataro et al., 1987 |
| Stx2e | stx2e, 1:5 AB-Toxin (70 kDa) | Pierard et al., 1991 |
a: Große strukturelle Untereinheit
b: Kleine strukturelle Untereinheit und/oder Untereinheit der Fimbrienspitze
c: Reifes AIDA-I Adhäsin wurde durch SDS-PAGE mit 100 kDa nachgewiesen.
Nicht alle ETEC-Stämme besitzen F4-Fimbrien und dies erklärt unter anderem einige der Unterschiede, die bei PWD zwischen den Betrieben beobachtet wurden. Dennoch führt die Impfung einer Sau während der Trächtigkeit zur Sekretion von antigen-spezifischen Antikörpern ins Kolostrum und die Milch, was Saugferkel vor ETEC-Infektionen schützen kann. Das Absetzen führt jedoch zum Verlust von Antikörpern und IgG, die in der Milch enthalten sind, was zur erhöhten Anfälligkeit der Schweine gegenüber Darminfektionen durch E. coli nach dem Absetzen beizutragen scheint, weshalb folglich eine aktive mukosale Immunantwort notwendig ist um einen Schutz zu bieten. Vor allem ist die Aktivierung des mukosalen Immunsystems des Dünndarms, insbesondere der jejunalen Peyer-Plaques, erforderlich um F4-antigenspezifische IgA- oder IgM-Reaktionen hervorzurufen und eine schützende mukosale Immunantwort auszulösen. Wie aus Abbildung 1 hervorgeht, braucht es jedoch nach dem Absetzen einige Zeit, bis die IgA-Spiegel als Reaktion auf pathogene Erreger ansteigen.
Da ETEC-Stämme die weitaus häufigste und wichtigste Ursache von PWD sind, wurde bei der Entwicklung von Impfstoffen in erster Linie diese Gruppe pathogener E. coli ins Visier genommen. Bereits seit vielen Jahren arbeitet man an der Entwicklung von Impfstoffen gegen PWD. Wie allerdings auch Zhang (2014) bestätigt, ist es keine leichte Aufgabe, kostengünstige Impfstoffe gegen PWD zu entwickeln. Enterotoxine bestimmen die Virulenz von PWD und müssen deshalb als Impfstoff-Komponenten berücksichtigt werden, selbst wenn LT, STa und STb stark toxisch sind und nicht als sichere Antigene benutzt werden können. Infolgedessen müsste ein wirksamer PWD-Impfstoff zur antiadhäsiven Immunität gegen K88- und (oder) F18-Fimbrien sowie zur antitoxischen Immunität zumindest gegenüber LT, STa und STb führen. Diese Fimbrien und Toxine sind genetisch und immunologisch heterogen und deshalb bietet die Immunität, die durch eine Fimbrie oder ein Toxin hervorgerufen wird, nur einen Schutz gegenüber ETEC-Stämmen, die die gleiche Fimbrie oder das gleiche Toxin exprimieren. Es kommt aber zu keiner Kreuzimmunität gegenüber ETEC-Stämmen, die andere Fimbrien oder Toxine exprimieren.
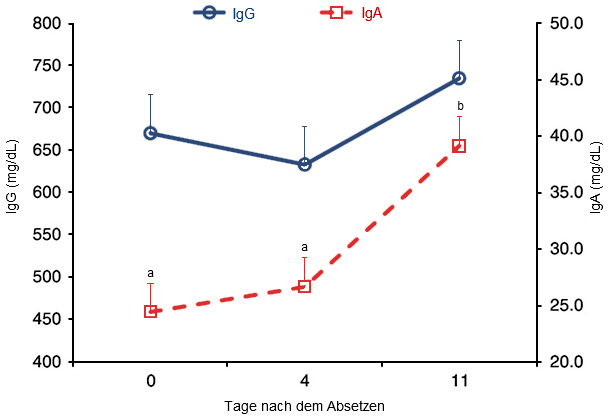
Abbildung 1: Konzentrationen von Plasma-IgG und -IgA (mg/dL) am Tag 0, 4 und 11 nach dem Absetzen. Die Konzentration von IgA war am Tag 11 nach dem Absetzen höher (P < 0,001) als am Tag 0 oder 4 nach dem Absetzen [Die Schweine wurden am Tag 0 abgesetzt und am Tag 1, 2 und 3 nach dem Absetzen E. coli F18 ausgesetzt. Plasma wurde am Tag 0 entnommen, bevor die Ferkel in den Aufzuchtstall kamen] (Sugaharto et al., 2014).
Darüber hinaus exprimieren Schweine mit unterschiedlichen genetischen Anlagen unterschiedliche Rezeptoren und diese Rezeptoren werden von spezifischen Fimbrien erkannt und angehaftet, die wiederum von verschiedenen ETEC-Stämmen exprimiert wurden. Bei oraler Immunisierung mit einem fimbrialen Impfstoff entwickeln nur Schweine, die spezifische Rezeptoren für diese Fimbrien exprimieren, eine wirksame Immunantwort. Dennoch sollte ein wirksamer PWD-Impfstoff zur schützenden antiadhäsiven Immunität gegen K88- und (oder) F18-Fimbrien, aber auch zur antitoxischen Immunität gegenüber LT- und ST-Toxinen führen. Der Einsatz eines toxoiden Antigens mit multiplen Epitopen (MEFA) (einschließlich neutralisierender Antikörper gegen Toxine) hat es generell ermöglicht, die multiple Adhäsion und Toxin-Antigene in ein einziges Produkt zur Entwicklung zuverlässig schützender PWD-Impfstoffe mit einem wirklich breiten Wirkspektrum einzubeziehen. Vor der Marktfreigabe sind aber noch weitere Experimente erforderlich.
In der Praxis sollten Saugferkel 10 Tage bis 2 Wochen vor dem Absetzen immunisiert werden, damit sie bis dahin aktiv Antikörper bilden können. Die erforderliche Konzentration an passiv erworbenen maternalen Antikörpern bei Saugferkeln muss jedoch hoch genug sein, um einen Schutz vor neonataler Diarrhö zu gewährleisten, aber niedrig genug um die immunisierten Antigene in ihrer Funktion, spezifische Antikörper gegen PWD zu induzieren, nicht zu beeinträchtigen. Die Impfung einzelner Schweine oder orale Immunisierung mit Lebendimpfstoffen beim Absetzen (z. B. durch Zugabe von Impfstoffen ins Futter oder Trinkwasser) sind Mittel, mit denen die Immunität gefördert werden kann.





